| е…ғзҙ еҗҚз§° |
ж°ҳь/span> |
е…ғзҙ з¬ҰеҸ· |
Xe |
еҺҹеӯҗеәҸж•° |
54 |
зӣёеҜ№еҺҹеӯҗиҙЁйҮҸ
(12C=12.0000) |
131.29 |
| иӢұж–ҮеҗҚз§° |
Xenon |
| еҺҹеӯҗз»“жһ„ |
еҺҹеӯҗеҚҠеҫ„(?) |
1.24 |
еҺҹеӯҗдҪ“з§Ҝ(cm3/mol) |
37.3 |
з”өеӯҗжЁЎеһӢ |
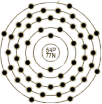
|
| з”өеӯҗжһ„еһӢ |
1s22s2p63s2p6d104s2p6d105s2p6 |
зҰ»еӯҗеҚҠеҫ„(?) |
|
| е…ұд»·еҚҠеҫ„(?) |
1.31 |
ж°§еҢ–жҖ?/span> |
0 |
| еҸ‘зҺ° |
1898е№ҙз”ұ William Ramsay е’ M.W. Travers (иӢұеӣҪпјҢдјҰж•?еҸ‘зҺ°гҖҒь/span> |
| е‘ҪеҗҚиө·жәҗ |
from 'xenos' (Greek) - stranger |
| жқҘжәҗ |
д»Һж¶ІеҢ–з©әж°”еҸҜиҺ·еҫ—жһҒе°‘йҮҸгҖҒь/span> |
| з”ЁйҖ“ь/span> |
з”ЁдәҺй—Әе…үзҒҜпјҢеҸ‘е°„зҒҜпјҢзҙ«еӨ–зҒҜпјҢе’Ңе…¶е®ғз”өзҒҜгҖҒь/span> |
| зү©зҗҶжҖ§иҙЁ |
зҠ¶жҖ?/span> |
ж— иүІпјҢж— иҮӯпјҢж— е‘ізҡ„жғ°жҖ§ж°”дҪ“гҖҒь/span> |
зҶ зӮ?в„? |
-111.7 |
жІ зӮ?в„? |
-107.97 |
| еҜҶеәҰ(g/ccпј?00K) |
5.9 |
жҜ зғ?J/gK) |
0.158 |
и’ёеҸ‘зғ?KJ/mol) |
12.636 |
| зҶ”еҢ–зғ?KJ/mol) |
2.297 |
еҜјз”өзҺ?106/cm) |
- |
еҜјзғӯзі»ж•°(W/cmK) |
0.0000569 |
| иҮӘзҮғзӮ?в„? |
- |
й— зӮ?в„? |
- |
|
|
| еҢ–еӯҰжҖ§иҙЁ |
|
| ең°иҙЁж•°жҚ® |
дё?nbsp; еә?/span> |
|
ж»һз•ҷж—¶й—ҙ(е№? |
- |
еӨӘйҳі
(зӣёеҜ№дә H=1Г—1012) |
- |
| жө·ж°ҙдё?ppm) |
1Г—10-4 |
ең°еЈі(ppm) |
2Г—10-6 |
еӨ§иҘҝжҙӢиЎЁйқЎь/span> |
- |
| еӨӘе№іжҙӢиЎЁйқЎь/span> |
- |
еӨ§ж°”(ppm(дҪ“з§Ҝ)) |
0.086 |
еӨ§иҘҝжҙӢж·ұеӨғь/span> |
- |
| еӨӘе№іжҙӢж·ұеӨғь/span> |
- |
|
|
|
|
| з”ҹзү©ж•°жҚ® |
дәәдҪ“дёӯеҗ«йҮҺь/span> |
|
иӮ?ppm) |
йӣөь/span> |
| еҷЁе®ҳдё?/span> |
|
иӮҢиӮү(ppm) |
йӣөь/span> |
| иЎҖ(mg dm-3) |
з—•йҮҸ |
ж—Ҙж‘„е…ҘйҮҸ(mg) |
жңӘзҹҘпјҢдҪҶйқһеёёдҪҺгҖҒь/span> |
| йӘ?ppm) |
йӣөь/span> |
дә?70Kg)еқҮдҪ“еҶ…жҖ»йҮҸ(mg) |
жңӘзҹҘпјҢдҪҶеҫҲе°‘гҖҒь/span> |
 m.cnreagent.com
m.cnreagent.com




 ж°ҷзҒҜиҖҒеҢ–иҜ•йӘҢз®°ь/div>
ж°ҷзҒҜиҖҒеҢ–иҜ•йӘҢз®°ь/div>

 GY-XDж°ҷзҒҜиҖҗеҖҷиҖҒеҢ–иҜ•йӘҢз®°ь/div>
GY-XDж°ҷзҒҜиҖҗеҖҷиҖҒеҢ–иҜ•йӘҢз®°ь/div>

