将各类电池的相关材料归纳起来,可分为氧化物、碳素材料、合金、聚合物四类。
第一类是氧化物,包括镍氢电池的正极材料Ni(OH)2,锂离子电池的正极材料LiCoO2,LiNiO2,LiNixCo1-XO2,LiMn2O4,V2O5等,还有锂离子电池的氧化物负极材料和固体氧化物电解质,固体氧化物燃料电池的氧化物催化电极等也应包括在内。
第二类是碳素材料,包括锂离子电池的负极材料,如石墨、硬碳和中间相微球碳等;还包括超级电容器用的纳米碳管,这种纳米碳管还可用于储氢材料,有可能成为氢能技术领域一个重要材料。
第三类是合金,主要指的是镍氢电池的负极材料储氢合金和锂离子电池的负极材料锡系合金等,后者实际上是一种储锂合金。
第四类是聚合物,包括质子交换膜燃料电池中的质子交换膜,锂离子电池中的聚合物电解质,超级电容器中也要用聚合物电解质。
锂离子电池由以下部件组成:正极、负极、电解质、电解质盐、胶粘剂、隔膜、正极引线、负极引线、中心端子、绝缘材料、安全阀、正温度系数端子(PTC端子)、负极集流体、正极集流体、导电剂、电池壳。
正极材料是含锂的过渡金属氧化物、磷化物如LiCoO2、LiFePO4等,导电聚合物如聚乙炔、聚苯、聚吡咯、聚噻吩、活性聚硫化合物等;负极材料是可大量储锂的碳素材料,氮化物,硅基材料,锡基材料,新型合金等;电解质是锂盐的有机溶液,聚合物,无机固体;胶粘剂是含氟聚合物,乙丙橡胶,碳基材料,硅胶基凝胶,放射性交联聚合物等;隔膜材料是多孔性聚烯烃,聚酰胺无纺布等;正温度系数端子(PTC端子)是导电性填料与聚合物的复合材料;负极集流体材料是铜箔,铜网,不锈钢网,其他金属网;正极集流体材料是铝箔等;导电剂是石墨,炭黑,乙炔黑,胶体碳;电池壳是钢,铝等材料。
1、正极材料
嵌锂化合物正极材料是锂离子电池的重要组成部分。正极材料在锂离子电池中占有较大比例(正负极材料的质量比例为3:1~4:1),因此正极材料的性能将很大程度地影响电池的性能,其成本也直接决定电池成本高低。
目前正极材料的研究主要集中于氧化锂钴、氧化锂镍等电极材料,与此同时,一些新型正极材料(包括导电高聚物正极材料)的兴起也为锂离子电池正极材料的发展注入了新活力,寻找开发具有高电压、高比容量和良好循环性能的锂离子电池正极材料新体系是本领域重要研究内容。
1.1 LiCoO2正极材料
LiCoO2具有三种物相,即a-NaFeO2型层状结构的LiCoO2、尖晶石结构的LT-LiCoO2和岩盐相LiCoO2。层状LiCoO2氧原子采用畸变立方密堆积序列,钴和锂分别占据立方密堆积中的八面体(3a)和(3b)位置;尖晶石结构的LiCoO2中氧原子为理想立方密堆积排列,锂层中含有25%的的钴原子,钴层中含有25%锂原子;岩盐相晶格中Li+和Co3+随机排列,无法清晰地分辨出锂层和钴层。
目前在锂离子电池中应用较多的是层状结构的LiCoO2,其具有工作电压高、充放电电压平稳,适合大电流充放电,比能量高、循环性能好等优点,锂离子在键合强的CoO2层间进行二维运动,锂离子电导率高,扩散系数为10-9~10-7cm2·s-1,其理论容量为274 mAh·g-1,实际比容量为140 mAh·g-1左右。由于其具有生产工艺简单和电化学性能稳定等优势,所以是最先实现商品化的正极材料。
但LiCoO2价格昂贵,实际比容量仅为其理论容量274 mAh×g-1的50%左右,钴的利用率较低;LiCoO2的循环寿命已达到1000次,但仍有待于进一步提高;此外LiCoO2的抗过充电性能较差,在较高充电电压下比容量迅速降低。为克服LiCoO2存在的问题,人们研究采取了多种措施以提高LiCoO2的性能。
层状LiCoO2一般采用高温固相反应制备,为了获得纯相且颗粒均匀的产物,需要将焙烧和球磨技术相结合进行长时间或多阶段加热。高温固相合成方法工艺简单、利于工业化生产,但也存在如下缺点:(1) 反应物难以混合均匀,需要较高的反应温度和较长的反应时间,能耗大;(2) 产物颗粒较大且粒径范围宽,颗粒形貌不规则,调节半岛bd体育手机客户端 的形貌特征比较困难,导致材料的电化学性能不易控制。为了克服固相反应的缺点,采用溶胶-凝胶方法、喷雾分解法、沉降法等方法制备LiCoO2,这些方法的优点是Li+和Co2+离子间可以充分接触,基本上实现了原子级水平的均匀混合,并且较易实现对产物组成和粒径的可控制备。
此外,人们还采用了其他改性方法。如采用Ni,Al,Ti,Fe等元素对Co进行搀杂取代,以稳定层状材料结构、提高电化学性能并降低生产成本;在LiCoO2表面包覆Al2O3,P2O5,AlPO4,MgO等物质,改善电极材料与电解液间的恶性相互作用,减缓钴的溶解等。
1.2 LiNiO2正极材料
理想LiNiO2晶体具有与LiCoO2类似的a-NaFeO2型层状结构。LiNiO2的理论容量为275mAh/g,实际容量已达190-210 mAh/g。与LiCoO2相比,LiNiO2具有价格和储量上的优势。但LiNiO2在实际的生产和应用中还存在较多问题,为此,人们对LiNiO2的合成方法及掺杂改性方面进行了大量的研究。
LiNiO2合成条件苛刻,在合成过程中倾向于生成偏离化学计量比的产物Li1-xNi1+xO2。出现此现象的原因是:(1) 在高温合成条件下,锂盐容易挥发而导致缺锂现象产生;(2) 从Ni2+氧化到Ni3+的电势差大,难于完全氧化;(3) 高温下LiNiO2易发生相变和分解反应。比如在空气中超过720℃,LiNiO2就开始从六方相(R3m空间群)向立方相(Fm3m空间群)转变。因此在LiNiO2的合成过程中,应尽量降低合成温度、采用氧气氛、或锂过量的方法,减少锂挥发,抑制缺锂和“阳离子混排”现象的发生。另外,为克服高温固相反应时间长,温度高等缺点,大量研究对反应前驱体进行预混匀处理,使各元素离子均匀混合以降低烧成过程中的反应时间和温度。
LiNiO2存在的合成困难、结构相变和热稳定性差等缺点,其根源都与LiNiO2的内在结构有关。对LiNiO2进行元素掺杂以改善其结构,是提高LiNiO2比容量、改善循环性能以及稳定性的有效手段。在LiNi1-yMyO2搀杂化合物的研究中,Co搀杂的LiNi1-yCoyO2表现出良好的综合性能。由于钴和镍是位于同一周期的相邻元素,具有相似的核外电子排布,且LiCoO2和LiNiO2同属于a-NaFeO2型层状结构,因此可以将钴、镍以任意比例混合并保持产物的a-NaFeO2型层状结构。因而LiNi1-yCoyO2兼备了Co系和Ni系材料的优点:制备条件比较温和、材料的成本较低、同时电化学性能及循环稳定性优良,已经引起了研究者的广泛兴趣。目前LiNi1-yCoyO2的可逆比容量可达180mAh/g,远远高于LiCoO2和LiMn2O4,同时可以利用LiNi1-yCoyO2较高的不可逆容量为负极SEI膜的形成提供锂离子,从而减少正极的额外装载量。若以LiNi1-yCoyO2化合物为正极材料,电池的比能量将大幅度提高,该类材料的开发和应用呈现出良好的发展势头。
1.3 Li-Mn-O系正极材料
由于锰资源丰富、价格低廉、无毒无污染,被视为最具发展潜力的锂离子电池正极材料。Li-Mn-O系正极材料存在尖晶石型LiMn2O4和层状LiMnO2两种类型。
尖晶石型LiMn2O4具有安全性好、易合成等优点,是目前研究较多的锂离子电池正极材料之一。但LiMn2O4存在John-Teller效应,在充放电过程中易发生结构畸变,造成容量迅速衰减,特别是在较高温度的使用条件下,容量衰减更加突出。
为了改善LiMn2O4正极材料性能,人们采用了多种方法和措施。在采用高温固相反应方法制备LiMn2O4的基础上,人们又研究开发了固相配位反应方法、控制结晶方法、Pechini方法、溶胶凝胶方法、共沉淀方法等,通过优化反应条件可以使尖晶石型LiMn2O4正极材料的性能得到一定程度提高,但未从根本上解决容量衰减问题。此外许多研究工作通过向尖晶石相中添加其他元素离子的方法来改善容量损失现象,元素周期表中的大半元素已被人们尝试过。虽然有些元素的搀杂能够有效改善材料循环性能,但一般会引起初始容量的损失,也影响电池的使用效率,因此该方面的工作尚需深入研究。
表面修饰方法是改善尖晶石型LiMn2O4正极材料性能的另一途径,通过在LiMn2O4正极材料表面包覆其他物质,可以减小材料的比表面积,抑制电解液与正极材料间反应的发生,并能达到高浓度体相搀杂的效果。表面修饰的方法可以增强电极材料的充放电稳定性,并改善其安全性,是一种较优良的材料改性方法。
三价锰化合物LiMnO2是近年来新发展起来的一种锂离子电池正极材料,具有价格低、比容量高(理论比容量286 mAh/g,实际比容量已达到200 mAh/g以上)的优势,已成为Li-Mn-O系锂离子电池正极材料研究领域的新热点。LiMnO2存在多种结构形式,其中属于单斜晶系的m-LiMnO2(空间群C2/m)和正交晶系的o-LiMnO2(空间群Pmnm)具有层状材料结构特征,并具有较优良的电化学性能,是目前研究的重点。对于层状结构LiMnO2而言,理想层状材料的电化学行为要比中间类型材料好得多。因此,如何制备及稳定LiMnO2的层状结构,使它能够经受上千次的充放电循环而不向尖晶石结构转变,是一个亟待解决的问题。
1.4 LiFePO4正极材料
LiFePO4正极材料是一类新型的锂离子电池用正极材料。由于铁资源丰富、价格低廉并且无毒,因此LiFePO4是一种具有良好发展前景的锂离子电池正极材料。
LiFePO4属于橄榄石型结构,空间群为Pnmb。此结构中Fe3+/Fe2+相对于金属锂的电压为3.4V,理论比容量170mAh/g,并且LiFePO4被氧化为FePO4-时,即充电过程中体积减小,可以弥补碳负极体积的膨胀,有助于提高锂离子电池体积利用率。但LiFePO4材料的电阻率较大,电极材料利用率低,因此研究工作主要集中在解决其电导率问题上。
包覆碳及加碳制成复合材料是提高LiFePO4材料电导率的有效方法之一。通过在合成LiFePO4前包覆碳的有机化合物前驱体容量可达 150mAh/g,循环 10次后,只有1%的容量损失。掺杂金属粉体及有机金属盐是提高LiFePO4材料电导率的又一方法。S. Y. Chung等人通过掺杂少量的金属离子(Mg2+,Al3+,Ti4+,Zr4+等)使掺杂后的LiFePO4的电导率提高了 8个数量级。
LiFePO4具有高的能量密度、低廉的价格、优异的安全性使其特别适用于动力电池。它的出现是锂离子电池材料的一项重大突破,成为各国竞相研究的热点。
1.5 导电高聚物正极材料
锂离子电池中,除了可以用金属氧化物作为其正极材料外,导电聚合物也可以用作锂离子电池正极材料。
目前研究的锂离子电池聚合物正极材料有:聚乙炔、聚苯、聚吡咯、聚噻吩等,它们通过阴离子的搀杂、脱搀杂而实现电化学过程。但这些导电聚合物的体积容量密度一般较低,另外反应体系中要求电解液体积大,因此难以获得高能量密度。
活性聚硫化合物是另一类聚合物正极材料,其工作原理与前述几种聚合物正极材料不同,是利用硫的氧化还原反应实现电化学过程。充电时含有巯基(SH)的有机硫化物单体被氧化(聚合)为含有S-S键的二硫化物或者聚合硫化物;放电时含有S-S键的硫化物又被还原(解聚)为有机硫化物单体。国外研究较多的有二巯基-噻二脞(DMcT)、三聚硫氰酸( TTCA)、四硫基-乙二胺( TTEA)等,其中以 DMcT的研究开发尤为引人注目。
DMcT作为锂离子电池的正极材料,在比能量方面有着优势,但其在室温下的电化学氧化还原的速度较慢,所以不能满足电池的大电流放电的要求。日本Oymam N等人通过采用导电聚合物如聚苯胺等对DMcT进行改性,达到分子水平的耦合,使其电极容量能达到225 mAh/g,表现出良好的发展前景。
2、负极材料
锂离子电池与二次锂电池的最大不同在于前者用嵌锂化合物代替金属锂作为电池负极,因此锂离子电池的研究开发,很大程度上就是负极嵌锂化合物的研究开发。
作为锂离子电池的负极材料,所必须具备的条件是:
(1) 低的电化当量;
(2) 锂离子的脱嵌容易且高度可逆;
(3) Li+的扩散系数大;
(4) 有较好的电子导电率;
(5) 热稳定及其电解质相容性较好,容易制成适用电极。
目前,锂离子电池的负极材料主要有碳素材料和非碳材料两大类,具体分类如下图所示。已实际用于锂离子电池的负极材料基本上都是碳素材料,如人工石墨、天然石墨、中间相碳微球(MCMB)、石油焦、碳纤维、热解树脂碳等,此外,人们也在积极研究开发非碳负极材料。
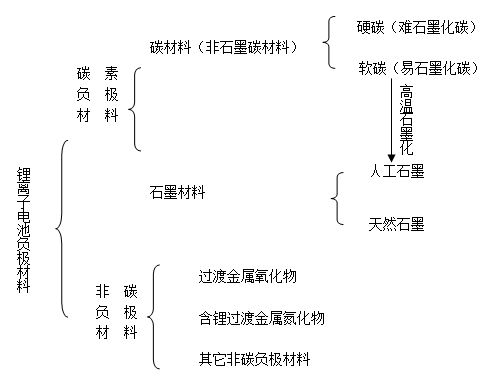
锂离子电池负极材料分类
2.1 碳素负极材料
碳材料根据其结构特性可分成两类:易石墨化碳及难石墨化碳,也就是通常所说的软碳和硬碳材料。通常硬碳的晶粒较小,晶粒取向不规则,密度较小,表面多孔,晶面间距(d002)较大,一般在0.35~0.40nm,而软碳则为0.35nm左右。
软碳主要有碳纤维、碳微球、石油焦等。其中,普通石油焦的比容量较低,约为160 mAh·g-1,循环性能较差,对石油焦(国产)等通过改性处理,可使比容量提高到250 mAh·g-1,并且具有较好的循环性能。
硬碳中主要有树脂碳,有机聚合物(PVA、PVC、PVDF、PAN等)热解碳以及碳黑(如乙炔黑)等。其中最为典型的是聚糠醇树脂碳PFA-C,它由日本索尼公司成功开发并最早用于其生产的锂离子电池中,其最大容量达到400 mAh·g-1,超过了LiC6的理论值,当在PFA-C中添加磷化合物可使其比容量进一步提高。PFA-C晶面间距(d002)较大,为0.37~0.38nm,与LiC6的晶面间距(d002)0.37nm相当,有利于锂离子的嵌入而不引起其结构明显膨胀,具有很好的充放电循环性能。
锂离子在聚合物热解碳中的脱嵌比容量除了与聚合物热解碳的结构种类有关外,与其热解碳化温度关系密切,通常在800℃以下热解时得到的碳的比容量较高(500~900 mAh·g-1),其中含氢等非碳成分较高,同时不可逆容量也较大。对于这类碳材料的嵌锂量远远大于LiC6的理论容量372 mAh·g-1的现象目前有多种看法,其中之一认为碳材料中存在纳米孔洞能嵌入超出化学计量的锂;另外也有认为与材料中的含氢量有关,锂离子结合到六角碳环的氢端,并使碳键由sp2变为sp3等等。随着热解温度的提高,热解碳中氢等非碳成分减少,不可逆容量也随之减小,同时嵌锂量也有所下降。如何在获得高嵌锂量的同时,降低材料的首次不可逆容量,达到实用要求,是低温热解碳所需解决的难题。
与非石墨化碳材料相比,石墨导电性好,结晶度较高,具有良好的层状结构,更适合Li离子的脱/嵌,形成LiC6锂-石墨层间插入化合物Li-GIC。材料的充放电可逆容量可达到300 mAh·g-1以上,接近LiC6的理论比容量372 mAh·g-1,充放电效率通常在90%以上,不可逆容量一般低于50 mAh·g-1,锂在石墨中的脱/嵌反应或脱/嵌容量主要发生在0~0.25V左右(vs. Li/Li+),具有良好的充放电电压平台,与提供锂源的正极材料如LiCoO2、LiNiO2、LiMn2O4等匹配性较好,所组成的电池平均输出电压高,因负极不可逆容量额外需要消耗的正极材料较少,是一种性能较好的锂离子电池负极碳材料,目前生产的锂离子电池已大量采用石墨类碳材料作为电池的负极。
石墨材料主要包括人造石墨和天然石墨两大类。人造石墨是将易石墨化碳(软碳)经高温石墨化处理制得。作为锂离子电池负极材料的人造石墨类材料主要有石墨化中间相碳微球、石墨纤维及其他各种石墨化碳等。其中人们最为熟悉的是高度石墨化的中间相碳微球(HGMCMB)。
HGMCMB其整体外型呈现球形,为高度有序的层面堆积结构。它由日本大阪煤气公司最先开发、生产,用于锂离子电池负极材料。HGMCMB可由煤焦油(沥青)或石油渣油(沥青)制得。它在700℃以下热解碳化处理时,锂的嵌入量可达到600 mAh·g-1以上,但不可逆容量较高;热处理温度在1000℃以上时,随着温度升高,HGMCMB的石墨化程度提高,其可逆容量增大,不可逆容量降低,通常其石墨化温度控制在2800℃以上,其可逆容量可达到300 mAh·g-1左右,不可逆容量小于10%,循环性能优良。
天然石墨中有无定形石墨与高度结晶有序石墨即鳞片石墨两种。对这两类天然石墨进行过对比研究,发现典型的无定形石墨半岛bd体育手机客户端 一般纯度较低,在90%以下,石墨晶面间距(d002)为0.336nm左右,主要为2H晶面排序结构,即石墨层按ABAB……顺序排列,锂在其中的可逆比容量较低,仅为260 mAh·g-1左右,而不可逆容量较高,达到100 mAh·g-1以上。无定形石墨中杂质含量高,影响其可逆容量,而较高的不可逆容量估计与其无定形结构有直接关系,类似于硬碳材料。典型的鳞片石墨半岛bd体育手机客户端 纯度可达到99.9%以上,石墨晶间距(d002)为0.335nm左右,主要为2H+3R晶面排序结构,即石墨层按ABAB……及ABCABC……两种顺序排列。鳞片石墨不可逆容量明显低于无定形石墨,一般小于50 mAh·g-1,含碳量为95%时,可逆容量为240~280 mAh·g-1;含碳量提高到99%以上时,其可逆容量可达到300~350 mAh·g-1。
石墨材料由于其石墨化结晶度高,具有高度取向的层状结构,对电解液较敏感,须采用碳酸乙烯酯(EC)等有机电解液体系。同时,由于石墨层间距(d002<0.34nm)小于锂插入石墨层后形成的LiC6石墨层间插入化合物的晶面层间距(d002=0.37nm),在有机电解液中进行充放电过程时,石墨层间距变化较大,并且还会发生锂与有机溶剂共同插入石墨层间以及有机溶剂的进一步分解,容易造成充放电过程中石墨层逐渐剥落、石墨颗粒发生崩裂和粉化,从而影响到石墨材料以及其作为负极的电池循环性能,因此一般对石墨表面采取氧化、镀铜、包覆聚合物热解碳或锡的氧化物等非碳材料等方法对石墨进行改性处理,以改善其充放电循环性能,并可进一步提高石墨材料的比容量,达到实用要求。
2.2 非碳负极材料
对LixFe2O3、LixWO2、LixMoO2、LixNb2O5等过渡金属氧化物材料研究工作开展比较早,与LixC6嵌入化合物相比,这些材料的比容量较低,因而基本上未能得到实际应用。锡的氧化物(包括氧化亚锡、氧化锡及其混合物)具有一定的可逆储锂能力,储锂容量比石墨材料高得多,可达到500 mAh·g-1以上,其中采用低压气相沉积法制备的晶型氧化锡(SnO2)的循环性能比较理想,充放电循环100次容量几乎不衰减,显示了一定的应用前景。通过向锡的氧化物中掺入B、P、Al及金属元素的方法,制备出非晶态(无定形)结构的锡基复合氧化物[通式为SnMxOy(x≥1)],其可逆容量达到600mAh·g-1以上,体积比容量大于2200 mAh·cm-3,是目前碳负极材料(500~1200 mAh·cm-3)的2倍以上,循环性能也较好。该材料目前的问题是首次不可逆容量仍较高,充放电循环性能也有待进一步改进提高。
含锂过渡金属氮化物是在氮化锂Li3N高离子导体材料(电导率为102·cm-1)的研究基础上发展起来的,可分为反CaF2型和Li3N型两种,代表性的材料分别为Li3-xCoxN和Li7MnN4。Li3-xCoxN属于Li3N型结构锂过渡金属氮化物(其通式为Li3-xMxN,M为Co、Ni、Cu等),该材料比容量高,可达到900 mAh·g-1,没有不可逆容量,充放电平均电压为0.6V左右,同时也能够与不能提供锂源的正极材料匹配组成电池。Li7MnN4属于反CaF2型结构锂过渡金属氮化物(其通式为Li2n-1MNn,M代表过渡金属),比容量较低,约为200 mAh·g-1,但循环性能良好,充放电电压平坦,没有不可逆容量,特别是这种材料作为锂离子电池负极时,还可以采用不能提供锂源的正极材料与其匹配组成电池。
TiS2、MoS2等硫化物也可作锂离子电池的负极材料,可与LiCoO2、LiNiO2、LiMn2O4等4V级正极材料匹配组成电池。这类电池电压较低,如以TiS2为负极,LiCoO2为正极组成电池,电压为2V左右,其循环性能较好,可达到500次。另外,某些合金材料具有较高的充放电容量,如Mg2Si合金的充放电比容量可达到1000 mAh·g-1以上,锂在Sn2Fe合金材料中的充放电可逆容量达到700 mAh·g-1,但它们的循环性能还不理想。
3、电解质
电解质作为电池的重要组成部分,在正、负极之间起到输送离子和传导电流的作用,选择合适的电解质是获得高能量密度和功率密度、长循环寿命和安全性能良好的锂离子电池的关键。
为满足锂离子电池高电压(>4V)性能的要求,作为锂离子电池实用的电解质应该满足以下条件:
(1) 电解质具备良好的离子电导率而不能具有电子导电性,一般温度范围内,离子电导率要高于10-3S·cm-1数量;
(2) 电解质应具有0~5V的电化学稳定窗口,以满足高电位电极材料充放电电压范围内电解质的电化学稳定性和电极反应的单一性;
(3) 化学稳定性高,即与电池体系的电极材料如正、负极、集电极、隔膜、胶粘剂等不发生发应;
(4) 良好的热稳定性,使用的温度范围尽可能宽;
(5) 良好的安全性和尽可能低的毒性,最好能够生物降解;
(6) 价格低廉,原料易得。
3.1 有机液体电解质
一般锂离子电池采用的电解质为有机液体电解质,它由有机溶剂和导电盐组成。有机溶剂的选择原则为:
(1) 有机溶剂的电化学和化学稳定性要好。在电池充放电过程中不与正负极材料发生电化学反应,也不能被电极材料催化而发生分解反应;
(2) 有机溶剂应具有较高的介电常数及较小的粘度系数以降低离子迁移阻力,使电解质具有较高的锂离子导电性;
(3) 有机溶剂的沸点要高而熔点要低,以使电池具有较宽的工作温度范围。
目前多采用碳酸酯系列高纯有机溶剂,如 EC(Diethylene Carbonate 二乙烯碳酸酯),PC(Propylene Carbonate 丙烯碳酸酯),DMC(Dimethyl Carbonate 二甲基碳酸酯),DEC(Diethyl Carbonate 二乙基碳酸酯)等作为溶剂。一些文献中也报道了采用THF(Tetrahydrofuran 四氢呋喃),2-MeTHF(Dimethyl Tetrahydrofutan 二甲基四氢味哺)等作为溶剂。另外,单一溶剂在性能上往往不能同时达到上述各项要求,而将多种溶剂按一定的比例混合后得到的多组分混合溶剂性能上优于单一溶剂,易于满足上述要求,因此在实验室研究及工业生产中大多采用多组分混合溶剂(如 EC+DMC,EC+DEC等)作为锂离子电池的电解质溶剂。
导电盐的选择原则为:(1)导电盐与电极活性物质应当在较宽的电压范围内稳定共存,在电池充放电时不与电极活性物质发生电化学副反应;(2) 导电盐在有机溶剂中应当具有较高的溶解度,容易解离。
能够较好地符合上述要求的导电盐有LiClO4,LiPF6及LiAsF6等。早期研究中多采用LiClO4作为导电盐,但它是强氧化剂,使用不安全(国外实验室有过爆炸记录),所以目前已商品化的锂离子电池都未采用LiClO4作为导电盐。商品化电池中大多使用LiPF6或LiAsF6等作为导电盐。但LiPF6或LiAsF6提纯困难,价格昂贵,并且LiAsF6还具有一定的毒性,因此各国仍在不断研究寻找更好的导电盐。
目前,在锂离子电池的研制开发及工业生产中,性能较好、应用最广泛的电解质是1~2M LiPF6+EC+DMC(7:3~2:8体积比)。
但有机液体电解质也存在不足之处:(1) 它的电导率比最好的水溶液电解质要低两个数量级。为补偿电导率的不足,就必须增加电极的面积和使用较薄的隔膜,相应电池的体积和形状都要受到影响;(2) 电池首次充电过程中不可避免地都要在碳负极与电解质的相界面上反应,形成覆盖在碳电极表面的钝化薄层,人们称之为固体电解质膜或称SEI膜(Solid Electrolyte Interface)。SEI膜的形成造成不可逆能量损失,而且也增加了电极/电解质界面的电阻,造成一定的电压滞后;(3) 对于可燃性有机电解质,电池短路或另外一些热源都可引起溶剂蒸气压的增大,从而导致电池的安全放气孔打开,放出热气流,如果热气流的温度超过它的着火点或附近有火源,气体就会燃烧降低电池的安全性能。
3.2 聚合物电解质
以聚合物电解质代替有机电解质来装配塑料锂离子电池PLI(Plasticizing Li-Ion)是锂离子电池的一个重大进步。其主要优点是高能量与长寿命相结合,具有高的可靠性和加工性,可以做成全塑结构。聚合物电解质也可以和塑料电极叠合,使PLI电池可以制成任意形状和大小,其应用将更加广泛。
早在1975年,Feulllade和Perche就制成了PAN和PMMA基离子导电膜。目前开发的聚合物电解质主要有PEO基、PMMA基、PAN基、PVDF基和PVC基聚合物。在这几类聚合物基础上形成的共聚物电解质膜如P(VDF-HFP)、P(AN-Co-MMA-CO-ST)、P(VC-CO-VAC)等的报道也比较多,是目前锂离子电池研究的一个热点。下表为一些聚合物电解质的电导率,有关数据说明聚合物电解质的电导率已能满足现阶段锂离子电池发展的基本要求。
| 电解质种类 | 组成(摩尔比) | 电导率(S·cm-1) |
| PAN-LiClO4-EC-PC | 21:8:38:33 | 1.1×10-3 |
| PAN-LiAsF6-MEOX-EC-PC | 33.8:6:11.5:33.8:27.7 | 2.98×10-3 |
| PMMA-LiCl4-EC-PC | 30:4.5:46:5:19 | 0.7×10-3 |
| PMMA-LiN(CF3SO2)2-EC-DMC | 25:5:50:20 | 0.7×10-3 |
| PEO-LiN(CF3SO2)2-PEGDME | 14.3:408:80.9 | 0.1×10-3 |
| PEO-LiN(CF3SO2)2-PEGDME-PC | 18.7:6.6:56:18.7 | 1.9×10-3 |
| 附: PAN=Poly(acrylonitrile) PEO=Poly(ethylene oxide) PMMA=Poly(methacrylate) PEGDME=Poly(ethyeneglycol) |
||
3.3 无机固体电解质
固体聚合物电解质在实际使用时会发生锂离子电导率降低及电化学性能不稳定等现象。因此,人们又发展了一类新的无机固体电解质。1984年,M. Menetrier等研究了0.28B2S3-0.33Li2S-0.39LiI三元玻璃电解质作为常温全固态锂二次电池的电解质。1986年R. Aames等报道用玻璃态P2S5-LiS-LiI三元电解质组装成的Li/LiI-Li4P2S5/TiS电池具有良好的贮存性能,贮存一段时间后,电池的电化学性能比新组装的电池的电化学性能要好。虽然固态电解质相对于液体电解质具有不易漏液、安全和易安装等优点,但在固体中低的离子迁移率和较差的机械形变性限制了它们在实际生产中的应用。为了改善机械性能,在玻璃电解质中添加一些导电聚合物改善玻璃电解质的机械性能的同时也提高了离子的电导率。Jaephil Cho等研究了(100-x)%0.19B2S3-0.25LiI-0.56Li2S) 和x%[P(EO)6LiN(CF3SO2)2] 聚合物电解质(其中x指体积百分比),发现这类电解质对LixMn2O4和碳电极的稳定性能良好。但总体上讲,无机固体电解质的价格较高,电导率偏低,要实现实用化还有大量工作要做。
4、隔膜材料
锂离子电池隔膜纸在锂离子电池中的作用是把正负极材料隔离。隔膜纸的质量直接地影响了电池的安全性能及容量等。故选用优质的隔膜纸已经是电池生产厂家的必经之路。隔膜纸通常有两种类型,其一,选用PP、PE、PP三层合拼隔膜纸,目前有美国CELGARD及日本UBE。此类型隔膜纸特点在于降低成本,但制造工艺复杂,对超薄16μm以下尤为难做到。其二,单层PE隔膜,目前有日本旭化成、东燃、美国ENTEK三家公司。此类型隔膜纸由于是单层PE,故生产成本较高,但对制造超薄16μm以下隔膜尤为有条件,故获得大电池厂家如三洋、索尼、松下、万胜等青睐。日本优质电芯几乎全部采用单层PE隔膜。目前市场上新出现一种由德国德固赛公司以无纺布为支架,加涂层制得的锂离子电池隔膜材料,制备工艺相对简单,已经在批量供应中国市场。
传统的聚合物隔膜是以聚乙烯、聚丙烯为原料,经熔融挤出、拉伸、热定型等工艺,制备出微孔聚烯烃锂离子电池隔膜材料。该材料具有较高的孔隙率和抗撕裂强度、较好的抗酸碱能力和弹性等,在循环使用几百次后,其物理性和化学性能没有明显的改变。主要用在锂离子电池正负极之间的隔离,并在锂离子电池过度充电时,起着防止电池短路引起爆炸的过热自关闭保护作用,是锂离子电池的关键材料,主要的物化指标有:
单层厚度 20-50μ
孔径 0.03-0.09μ
孔隙率 35-50%
纵向强度≥50N
横向强度≥5N
自闭温度 95-165℃
隔膜材料作为锂离子电池的重要组成部分,目前世界上能生产此类隔膜材料的只有日本、美国及德国等少数几个国家,我国锂离子电池生产所需的隔膜材料全部依靠进口。
5、胶粘剂
胶粘剂主要作用是:粘附活性物质;使活性物质与集流体发生粘附;在充放电过程中起保存粘附活性物质及使活性物质与集流体发生粘附;在生产过程中形成浆状以利于涂布;对碳负极在插入锂时体积发生膨胀进行缓解。
胶粘剂必须具有良好的耐热性、耐溶剂性、电化学稳定性。
胶粘剂一般为含氟聚合物如PVDF,其他有聚酰胺、聚酯、环氧树脂、丙烯腈-丁二烯乳胶、乙丙橡胶、碳基材料、硅胶基凝胶、放射性交联聚合物等。
6、正温度系数端子
正温度系数端子可防止电池电流过大。正常温度下,正温度系数端子的电阻很小,但是当温度达到120℃左右时,电阻突然增大,导致电流迅速下降。当温度下降以后,正温度系数端子的电阻又变小,又可以正常充放电。
常见元件组分为导电性填料与聚合物的复合。
7、集流体材料
集流体必须具有的性能包括强、轻、薄、化学稳定、电化学稳定、与电极混合物材料(活性材料、胶粘剂、导电剂)具有良好的粘结性。
7.1 负极集流体材料
负极集流体材料一般用铜箔(10μm~20μm厚)。
铜箔作为一种有色金属箔体材料,用于锂电池负极集流体,主要要求其以下三项技术指标:(1)厚度(8μm~12μm);(2)拉伸强度( >30kg/mm2);(3)延伸率( >5%)
锂电池用铜箔大致可分为两种:(1)压延铜箔(光面);(2)电解(电沉积)铜箔(毛面)。日本的锂电池普遍采用8μm~10μm压延铜箔作为集流体,压延铜箔最大的优点在于相同厚度条件下,其拉伸强度和延伸率高于电解铜箔,制备圆柱型高能量密度锂电池要求铜箔不但要厚度薄,而且拉伸强度和延伸率要高,日本所用8μm~10μm压延铜箔能够满足此要求,而且日本企业一直采用压延铜箔,压延铜箔的性能和成本相对都要高于电解铜箔。将电解铜箔用于锂电池可以说是中国人的发明,在中国企业开始尝试生产锂电池之初,也使用压延铜箔,但是一方面国产压延铜箔的厚度难以达到10μm左右,另一方面压延铜箔的表面光滑,使负极浆料的涂布存在一定困难(估计日本企业存在铜箔表面处理和浆料添加特种黏附剂的工艺),所以国内企业改用电解铜箔(毛面),不但实现了国产化,而且负极涂布容易,负极材料黏附强度高,半岛bd体育手机客户端 合格率高,生产成本低,一直使用至今。
目前来看,中国锂电池厂商普遍采用10μm~15μm的电解铜箔,其性能完全能够满足移动通讯用1Ah以下的方型锂电池的需要,但用于高能量密度锂电池的低厚度(10μm以下)、高拉伸强度、高延伸率、高均匀性的高性能的铜箔(一般指压延铜箔,电解铜箔在8μm时强度和延伸率难以保证),还有待开发,而且电池加工工艺也需要和铜箔匹配才行。我国在相关技术方面的进步非常迅速,目前许多企业已经宣称能够提供10μm以下的高性能锂电池用铜箔。
7.2 正极集流体材料
正极集流体材料一般用铝箔(20μm厚)。
8、导电剂
由于活性材料的电导率低,一般加入导电剂以加速电子的传递,同时也能有效提高锂离子在电极材料中的迁移速率。
常用的导电剂为石墨、炭黑、胶体碳。
 m.cnreagent.com
m.cnreagent.com
